引用本文 倪文婧, 李婕, 南月敏. 非酒精性脂肪性肝病合并糖尿病的综合管理:2024年美国糖尿病学会指南解读 [J] . 中华肝脏病杂志, 2024, 32(6) : 504-507. DOI: 10.3760/cma.j.cn501113-20240119-00045. 通信作者: 李婕,南京中医药大学鼓楼临床医学院感染性疾病科,南京大学医学院附属鼓楼医院感染性疾病科 南月敏,河北医科大学第三医院中西医结合肝病科,河北省慢性肝病肝纤维化研究重点实验室,河北省国际科技合作基地——河北省肝癌分子诊断国际联合研究中心
|摘 要|
非酒精性脂肪性肝病(NAFLD)为成人2型糖尿病(T2DM)及糖尿病前期常见伴发疾病,T2DM/NAFLD患者为心血管疾病的高危人群,NAFLD及其相关肝纤维化的发生和发展、心血管疾病及其相关死亡严重影响患者预后。2024年美国糖尿病学会《糖尿病标准化管理指南》针对T2DM及糖尿病前期人群NAFLD,以及肝纤维化的筛查、评估、治疗及管理提出相关建议。在改善生活方式基础上,减重、控制血糖是减缓肝脏炎症及肝纤维化进展、降低心血管疾病风险的重要措施。 近年来,随着人群生活方式的转变,代谢性疾病的患病率日益增高。全球范围内,糖尿病患病人数达到5.29亿[1]。最新荟萃分析显示,全球糖尿病人群中非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)患病率为65.04%[2]。糖尿病与NAFLD共病加剧肝脏炎症及纤维化的进展,增加心血管及肾脏相关死亡风险,已成为临床重点关注的代谢性问题。 2024年1月,美国糖尿病学会(American Diabetes Association,ADA)在线发布新一版糖尿病标准化管理指南[3]。其中,2型糖尿病(type 2 diabetes mellitus,T2DM)合并NAFLD的管理为重点内容之一。本文就其筛查与治疗建议解读如下。 一、 成人T2DM及糖尿病前期NAFLD及非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)相关肝纤维化筛查、风险分层及管理 NAFLD疾病进程包括早期的单纯性肝脂肪变、NASH及其相关肝硬化、肝癌。其中,NASH为疾病进展的关键阶段。约50%的T2DM合并NAFLD患者会发生NASH。糖尿病是NASH发生、发展和肝脏不良结局的主要危险因素。 目前,无创肝纤维化评分肝纤维化4因子指数(fibrosis 4 score,FIB-4)是糖尿病前期、T2DM和具有其他心脏代谢风险因素患者肝纤维化筛查最经济有效的方法。ADA专家组提出了筛查与诊断流程(图1)。FIB-4评估肝纤维化风险计算模型包括年龄、转氨酶和外周血小板计数。FIB-4 < 1.3则进展期肝纤维化(F3~F4)和不良肝脏结局的发生风险低,FIB-4 > 2.67(F3~F4)则上述风险显著增高。FIB-4动态变化可预测肝纤维化进程,并可进行长期肝脏相关事件和病死率的个体化风险分层。FIB-4优势在于具有较好的特异度和阴性预测值,排除进展期肝纤维化,但缺乏足够的敏感性和阳性预测值[4],因此,许多糖尿病患者被判断为"不确定"或"中间"风险状态(FIB-4指数1.3~2.67)。鉴于FIB-4具有低成本、简捷和特异度高的特点,可作为初筛的首选指标(图1)。FIB-4指数会受到年龄影响,对于≥65岁糖尿病人群,建议采用1.9~2.0作为显著肝纤维化的诊断界值。
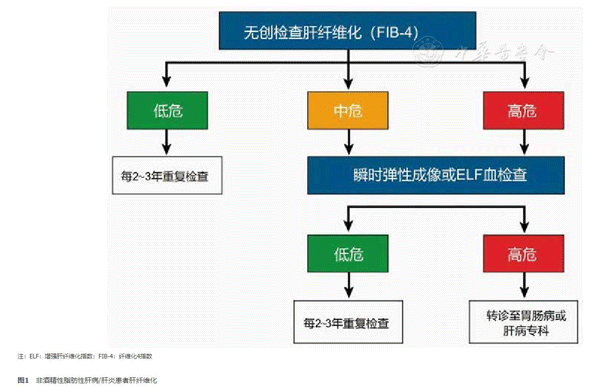
FIB-4指数为"不确定"期或较高水平者,需进一步采用瞬时弹性成像检测肝脏硬度(liver stiffness measurement,LSM)进行风险分层(图1);如LSM不能实施,ADA专家组推荐商业化的外周血肝纤维化生物标志物如增强肝纤维化指数(enhanced liver fibrosis,ELF)等进行风险分层。瞬时弹性成像是最有价值的肝纤维化进展风险分层技术,可预测NAFLD肝硬化和全因死亡风险。LSM < 8.0 kPa可排除进展期肝纤维化和肝硬化,并可预测低风险的显著肝纤维化[5]。ELF < 7.7患者为不良结局低风险,该类糖尿病患者可在非肝病专科接受≥2年一次的随访。如LSM > 12 kPa,则为进展期肝纤维化高风险,应由肝病专家诊治。FIB-4序贯LSM模式有助于糖尿病患者NAFLD肝纤维化的风险分层监测及降低专科转诊率(图1)。经上述路径评估处于肝纤维化"不确定期"或高风险的糖尿病患者应转诊至消化内科或肝病科进一步检查,采取多学科评估及管理[6]。
此外,磁共振弹性成像(magnetic resonance elastography,MRE)被认为是肝纤维化分层评估的无创"金指标",可用于进一步明确肝纤维化进展风险。然而,由于MRE可及性较低和检测费用昂贵,尚难以常规应用。肝活检仍是NASH及肝纤维化诊断的金标准,但由于其具有较高的成本和穿刺过程可能发生的出血等并发症风险,仅适于作为专业团队的专家决策手段。
二、 成人T2DM或糖尿病前期,NAFLD相关肝纤维化筛查、评估及管理推荐意见
1.T2DM或糖尿病前期,尤其合并肥胖、心脏代谢风险因素或已确诊心血管疾病患者,即使肝酶正常,应采用FIB-4进行临床显著肝纤维化(F2~F4)筛查和风险分层评估。(证据等级B) 2.T2DM或糖尿病前期患者血浆转氨酶水平持续升高> 6个月,且FIB-4水平较低,应接受其他肝病病因的评估。(证据等级B) 3.T2DM或糖尿病前期患者,若FIB-4指数不确定或偏高,应采用瞬时弹性成像LSM或基于血液生物标志物的ELF模型评估肝纤维化进展风险。(证据等级B) 4.T2DM或糖尿病前期患者,通过FIB-4、LSM或ELF评估,难以确定是否存在显著肝纤维化或为高风险,应转诊至消化内科或肝病科接受进一步检查,多学科协作长期管理。(证据等级B) 三、 成人T2DM人群NAFLD及其相关风险的治疗及管理 大量研究证实过多内脏及全身脂质沉积是超重和肥胖人群发生NASH的主要病理机制。肥胖加剧T2DM患者胰岛素抵抗,促进NASH进展及发生肝硬化。因此,对伴有超重/肥胖、NAFLD的糖尿病患者,临床医生应实施基于循证医学的干预措施,促进积极健康的生活方式和行为,减轻体质量至少5%,若超过10%效果更佳,可改善肝组织学、改善肝纤维化。对于NAFLD患者,个体化、结构化的减重和锻炼计划比标准化建议获益更多[7]。 低能量饮食推荐与无NAFLD的肥胖、糖尿病患者的饮食推荐无明显差异,包括降低常量营养素含量、限制饱和脂肪、淀粉和添加糖,采用更健康的饮食模式。地中海式饮食可有效改善肝脏和心脏代谢健康;有氧运动和阻力训练改善程度均与治疗参与度和项目强度有关。通过改变生活方式不能控制体质量的肥胖患者,可考虑减重药物治疗。 对于T2DM伴NASH,尤其存在显著肝纤维化(≥F2)患者,主要治疗目标为严格控制血糖和减重。T2D人群NASH患病率高,10%~15%伴发显著肝纤维化且易进展,一旦发展为肝硬化,缺乏有效治疗药物,肝脏相关死亡风险高,因此,NAFLD的早诊早治是预防肝硬化的重要策略。目前,美国食品和药品监督管理局批准瑞司美替罗(Resmetirom)用于治疗伴纤维化的成人NASH患者。在最新3期临床试验中,约69 %的NASH患者合并T2DM[4]。研究显示,干预组的肝脏组织学评分以及糖化血红蛋白水平均显著优于安慰剂组,显示出良好的肝组织学改善和降糖效果[8]。但其长远获益还有待进一步验证。吡格列酮和胰高血糖素样肽1受体激动剂(glucagon-like peptide 1 receptor agonists,GLP-1 RAs)也可有效治疗NASH、减缓肝纤维化进展[9],减少心血管事件,以降低T2DM心血管相关死亡风险。 吡格列酮可改善糖尿病前期/T2DM患者伴NASH[10]、无糖尿病NASH患者的糖脂代谢紊乱,有效缓解NASH,减轻肝纤维化。维生素E用于非糖尿病伴发NASH。单一维生素E治疗糖尿病NASH无效,吡格列酮联合维生素E疗效分析显示,维生素E未能增进吡格列酮治疗效果。 GLP-1 RAs可有效减轻体质量、降低血浆转氨酶水平、改善肝脂肪变。至今,仅有2项经肝活检病理学证实NASH治疗的病例对照研究验证上述结果。应用利拉鲁肽小型队列研究证实,NASH及肝纤维化均获得一定程度缓解。另有研究报道,320例经肝活检证实的NASH(62%为T2DM)患者接受司美格鲁肽治疗,NASH好转率在高剂量(2.4 mg/周)组达59%,对照组仅17%(P < 0.001)。其中70%患者基线肝纤维化分期为F2或F3,观察至72周内,司美格鲁肽显著减缓肝纤维化进展(高剂量GLP-1 RA组4.9%,安慰剂组18.8%)。替西帕肽[Tirzepatide,双重葡萄糖依赖性促胰岛素多肽(glucose-dependent insulinotropic polypeptide,GIP)和GLP-1RA]、钠-葡萄糖协同转运蛋白抑制剂及胰岛素均可减轻肝脂肪变,但对NASH的疗效尚不确定。除吡格列酮、GLP-1 RAs外,如有临床指征,其他降糖药仍可用于伴发NAFLD糖尿病的治疗,但在以肝活检评估的队列研究中,未能获得NASH缓解(如二甲双胍),或临床试验缺乏肝组织学终点的评估终点(如磺脲类、格列奈类、二肽基肽酶抑制剂或α-葡萄糖苷酶抑制剂)。 成人T2DM合并失代偿性肝硬化患者的血糖控制首选胰岛素。近期一项48周的研究表明,GLP-1 RAs对NASH和代偿性肝硬化患者安全性良好,而口服降糖药物和非胰岛素注射剂(GLP-1 RAs、GLP-1/GIPRAs)对失代偿期肝硬化的安全性和疗效尚无充分证据。 减重手术可改善NASH及心脏代谢健康状况,改变自然病程。荟萃分析显示,接受减重手术患者中,70%~80%肝脂肪变减轻,50%~75%肝脏炎症和肝细胞气球样变、坏死性炎症好转,30%~40%肝纤维化改善。减重手术可降低肝细胞癌发生风险。对于代偿性肝硬化患者,应谨慎选择减重手术。由于缺乏安全性和终点结局的数据,术后肝脏相关并发症风险高,不推荐对代偿性肝硬化患者行减重手术。 大量研究证实成人T2DM伴NAFLD患者为心血管疾病高风险人群,应加强心血管风险因素综合管理,遵照临床应用指征,启动或维持他汀类药物治疗可降低心血管疾病风险。他汀类药物可以安全地用于成人T2DM伴NASH患者、NAFLD相关代偿性肝硬化(Child-Pugh A~B)患者。慢性肝病患者应用他汀类药物可减少肝功能失代偿发生率及/或总体死亡率。但鉴于有限的安全性和有效性数据,不推荐NAFLD相关失代偿性肝硬化患者使用他汀类药物。 四、 成人T2DM或糖尿病前期、伴有超重或肥胖、NAFLD患者,生活方式、临床诊疗方案的推荐意见
1.对于T2DM或糖尿病前期,尤其伴有超重或肥胖、NAFLD患者,应改善生活方式、减重,制定合理的营养和体力活动方案,以改善心脏代谢(证据等级B)和改善肝脏组织学。(证据等级C) 2.T2DM,尤其伴有超重或肥胖、NAFLD患者,应考虑使用已证实在NASH治疗中有明显获益的GLP-1RA作为减重的辅助治疗。(证据等级B) 3.T2DM患者伴有经组织学检查证实的NASH或经无创检测手段证实存在显著肝纤维化,优先推荐采用吡格列酮或GLP-1RA控制血糖。(证据等级A) 4.T2DM伴NAFLD患者,除吡格列酮或GLP-1RA外,可根据临床指征选用其他降糖药物,但尚未证实对NASH有确切效果。(证据等级B) 5.T2DM伴失代偿期肝硬化患者,降糖药物首选胰岛素。(证据等级C) 6.T2DM伴NAFLD患者心血管风险增加,应采取降低心血管风险的综合管理措施。(证据等级B) 7.他汀类药物可安全用于T2DM合并NAFLD代偿性肝硬化的患者,应根据心血管风险临床指征启动及维持治疗。对于失代偿肝硬化患者,他汀类药物安全性和疗效数据不足,应谨慎使用他汀类药物并密切监测。(证据等级B) 8.NASH伴T2DM符合减重手术指征患者可考虑手术控制体质量(证据等级B)及改善心血管结局。(证据等级B) 9.T2DM伴NAFLD失代偿性肝硬化患者,应谨慎实施减重手术(证据等级B),失代偿性肝硬化患者不适宜手术减重。(证据等级B) 五、 总 结 NAFLD与T2DM共病已经成为临床常见现象。二者互相影响,共同促进疾病进展,增加肝内肝外不良结局的风险。该指南进一步强调对共病人群进行肝纤维化的筛查,FIB-4序贯LSM仍是当前筛查的首选模式。尽管已有相关药物获批治疗NAFLD伴肝纤维化,但其对NAFLD共病T2DM人群的长远获益还需更多研究证实。在将来,联合肝病科、内分泌科等其他多学科协作,共同管理NAFLD共病T2DM人群势在必行,以期构建更加精细化的分级诊疗,推动共病人群的精准管理。

 简体中文
简体中文
 ENGLISH
ENGLISH

