肝衰竭概念
不同地区对ACLF认识的差异
不同ACLF诊断标准的预后不同
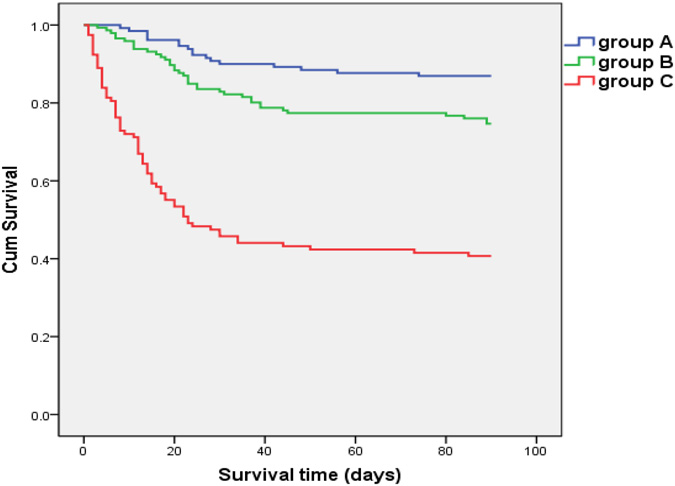
肝衰竭前存在“黄金窗口期”
肝衰竭前期诊断标准
肝衰竭前期可进行预警研究
急性肝衰竭的机制
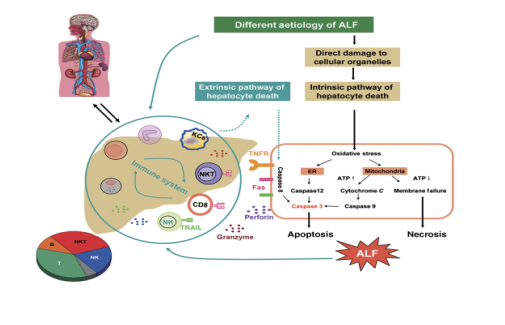
炎症相关指标
免疫反应相关指标
氧化应激相关指标
肝细胞再生相关指标
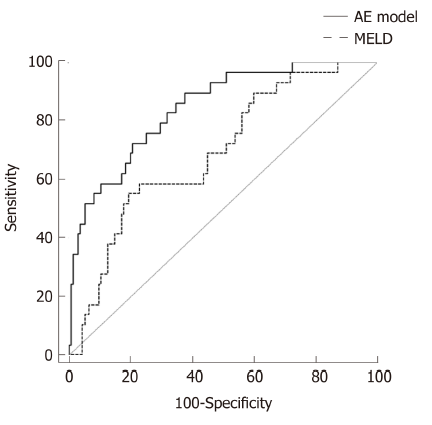
风险预测模型
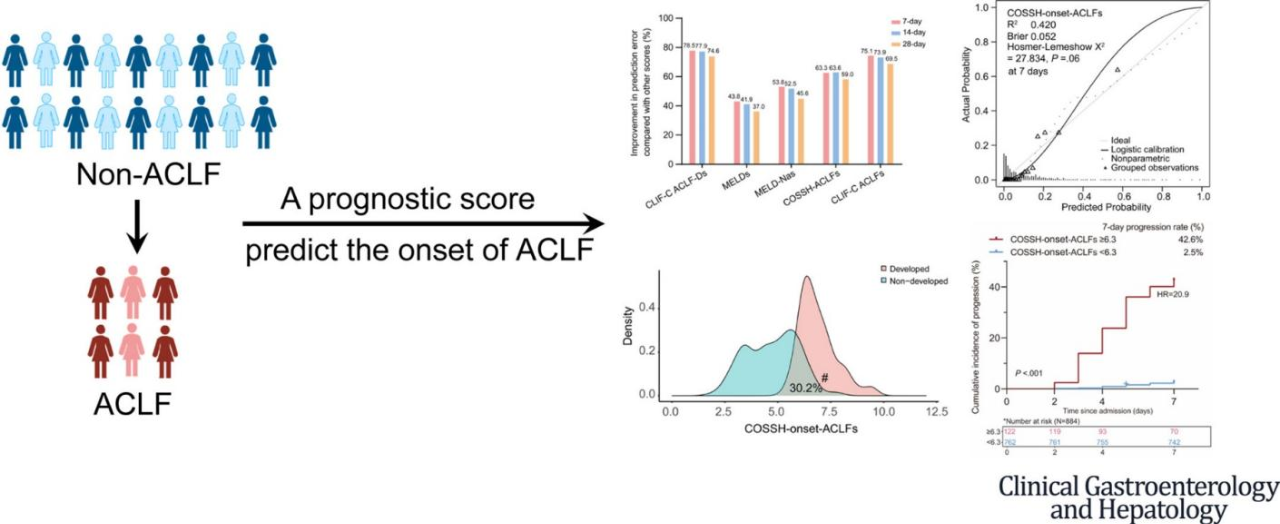
总结
肝衰竭概念
不同地区对ACLF认识的差异
不同ACLF诊断标准的预后不同
肝衰竭前存在“黄金窗口期”
肝衰竭前期诊断标准
肝衰竭前期可进行预警研究
急性肝衰竭的机制
炎症相关指标
免疫反应相关指标
氧化应激相关指标
肝细胞再生相关指标
风险预测模型
总结









评论
网友评论:
共评论。点击查看