作者/首都医科大学附属北京佑安医院 耿楠
终末期肝病(ESLD)指患者由于各种病因导致的肝硬化、肝衰竭和肝癌。肝脏是参与营养物质代谢和能量生成的重要器官;因此,终末期肝病患者常伴有代谢异常。如糖代谢异常:肝细胞合成、储存和分解糖原的能力下降,糖异生水平增加,能量代谢从碳水化合物转变为脂肪氧化。蛋白质代谢异常:用于糖异生的氨基酸主要来源于骨骼肌中蛋白质的水解,支链氨基酸在骨骼肌中分解代谢增加,抑制蛋白质合成,导致肌肉减少、功能储备下降[1]。
一项研究采用液相色谱-质谱联用技术对181例慢加急性肝衰竭(ACLF)患者、650例肝硬化急性失代偿患者、43例代偿期肝硬化患者和29例健康人的血清进行非靶向代谢组学研究,来探讨ACLF患者的代谢改变。正常情况下,葡萄糖在细胞质中磷酸化生成葡糖-6-磷酸,又通过一系列酶的催化作用生成丙酮酸,丙酮酸通过三羧酸循环产生ATP。这项研究发现,ACLF患者在系统性炎症的环境下,核糖-5-磷酸、乳酸、葡糖醛酸含量增加,表明糖酵解、磷酸戊糖途径及糖醛酸途径增强,葡萄糖优先快速激活先天免疫细胞产生ATP,而线粒体氧化磷酸化途径被抑制,这是ACLF多器官衰竭的重要机制[2]。
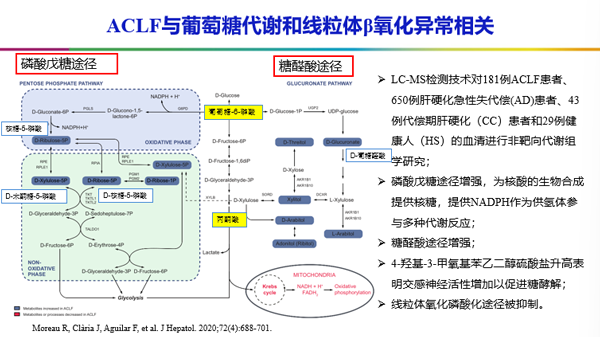
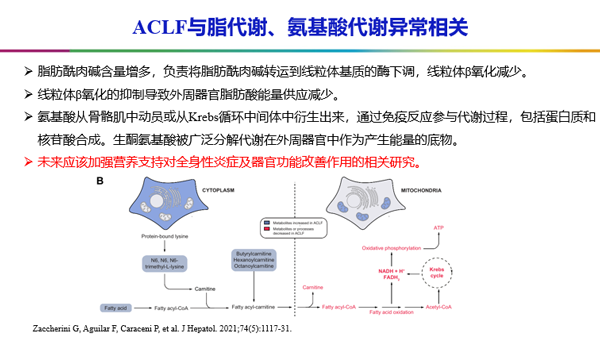
同时,这项研究也发现,在脂肪酸和氨基酸代谢方面也存在明显异常。在正常情况下,游离脂肪酸穿过细胞膜,进入细胞质,生成脂酰辅酶A,通过与肉碱结合穿过线粒体内膜,随后与肉碱分离,经过β氧化产生能量。这个循环不断重复,直到游离脂肪酸被还原为乙酰辅酶A,乙酰辅酶A通过氧化磷酸化产生ATP释放能量。在ACLF患者中,脂肪酰肉碱含量增多,负责将脂肪酰肉碱转运到线粒体基质的酶下调,线粒体β氧化减少。线粒体β氧化的抑制导致外周器官脂肪酸能量供应减少。氨基酸从骨骼肌中动员或从三羧酸循环中间体中衍生出来,通过免疫反应参与代谢过程,包括蛋白质和核苷酸合成。生酮氨基酸被广泛分解代谢在外周器官中作为产生能量的底物。未来应该加强营养支持对全身性炎症及器官功能改善作用的相关研究[3]。
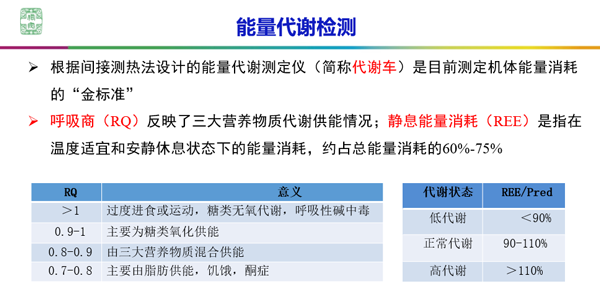
根据间接测热法设计的能量代谢测定仪(简称代谢车)是目前测定机体能量消耗的“金标准”。食物在人体内氧化时,需消耗空气中的氧气,产生二氧化碳,释放出能量。同一时间内二氧化碳生成量与氧耗量之比,称为呼吸商(RQ)。RQ反映了三大营养物质代谢供能情况。静息能量消耗(REE)是指在温度适宜和安静休息状态下的能量消耗,约占总能量消耗的60%-75%。
基于REE测定的高代谢与全身炎症活动增加相关。我团队姚佳博士一项研究纳入了105例HBV-ACLF。将患者分为3组,A组为入院后第1天、第7天实际REE/Pred>1.2,定义为持续高代谢组;B组为入院后第一天存在高代谢,入院第7天恢复正常;C组为入院后第一天、第7天均正常。结果分为以下4个方面:
1)持续高代谢组较其他两组28天死亡率明显增加;
2)REE与BMI、C反应蛋白存在正相关,而与肝功能无相关性;
3)持续高代谢和MELD评分是28天死亡率增加的独立危险因素;
4)在预测短期死亡率方面,持续高代谢与MELD评分联合优于单独MELD评分。
高代谢会加速能量消耗,导致负能量平衡,这会增加感染等并发症的风险。因此,通过肠内肠外营养干预使ACLF患者获得足够的能量至关重要[4]。另一项研究纳入了30例正常人和70例肝硬化患者来研究增加餐次对肝硬化患者底物代谢的作用,首先分析肝硬化患者与正常人空腹RQ和日间RQ的差异,又将70例肝硬化患者随机分为常规饮食组32例以及高频饮食组38例,两组摄入的总能量相同。一周后,研究发现,空腹和日间三个时间点上高频饮食组患者的RQ高于常规饮食组,因此增加餐次能够提高呼吸商改善底物代谢[5]。
2021年8月,美国肝病学会首次发布了肝硬化营养不良的临床实践指导,提出肝硬化营养不良通常表现为肌肉减少症和衰弱。肌肉减少症特指肌肉含量减少,衰弱特指身体衰弱,同时提出了计算机断层扫描成像是评估肝硬化患者肌肉质量的金标准[6]。
我团队徐曼曼博士在骨骼肌指数与ACLF预后关系方面的研究,纳入了171名经亚太标准诊断为ACLF的患者。男性第三腰椎骨骼肌指数(L3-SMI)值小于42cm2/m2,女性小于38 cm2/m2被诊断为肌肉减少症。研究发现,55.6%的ACLF患者合并肌少症,男性患病率为53.4%,女性为68.0%。肌少症与非肌少症患者相比,BMI较低,肥胖比例更少,肝硬化比例更高。血清肌酐水平、胆红素水平更高。通过多因素回归分析发现,肥胖是肌少症的保护因素,相反,肝硬化和高胆红素与肌少症发生率增加相关。通过多因素COX回归分析发现,肝硬化、胆红素、INR与死亡率相关,而L3-SMI和肌少症与ACLF短期死亡率未见显著相关[7]。
第三腰椎腰大肌指数(L3-PMI)相对于L3-SMI具有测量肌肉单一、测量面积小、边界清晰等特点,测量更加简便且准确性高。因此,我们进一步分析了L3-PMI对ACLF患者预后的预测价值。另一项研究共纳入了116例经亚太标准确诊ACLF的男性患者,单因素回归分析显示,L3-PMI是男性ACLF患者1年死亡率的保护因素。然而,多因素分析未发现两者之间存在独立关系。因为,L3-PMI与年龄存在交互作用,40岁以后的男性患者,L3-PMI随年龄增长而下降,因此,我们按年龄分组进行分析发现,校正MELD评分后,L3-PMI与小于40岁男性ACLF患者的1年病死率独立相关,而L3-PMI与大于40岁ACLF患者的1年病死率无关[8]。
L3-SMI是评估肌肉减少症,进而诊断营养不良的重要指标,具有客观性强、受水钠潴留影响小、可重复性好等优点。但中国缺少L3-SMI的正常值标准,不同种族之间的人体成分存在差异,欧美的研究结果也不适用于我们国家人群。为了弥补这一空白,段钟平教授牵头了一项多中心研究,参与单位有大连医科大学附属第二医院、兰州大学第一医院、南阳市第一人民医院,首次建立了中国正常成年人不同性别、不同BMI分层的L3-SMI参考值范围。
研究从放射科PACS系统中导出第三腰椎中间水平的横断面CT图像,使用SliceOmatic软件对肌肉和脂肪组织参数进行分析。以不同的CT阈值进行组织分割,肌肉组织的CT密度阈值为-29~+150HU。内脏脂肪组织的CT密度阈值为−150~−50HU,皮下脂肪组织的CT密度阈值为−190~−30HU。我们分析了L3-SMI与年龄之间的关系发现,男性和女性的L3-SMI与年龄均呈负相关,男性的相关性高于女性,L3-SMI与BMI呈正相关。我们使用两种亚洲肌少症工作组推荐的方法来定义低肌肉质量的L3-SMI参考值,低于第5百分位数男性L3-SMI<40.2 cm2/m2,女性L3-SMI<31.6 cm2/m2和低于平均值两个标准差,男性L3-SMI<37.9 cm2/m2,女性L3-SMI<28.6 cm2/m2[9]。
脂肪组织是人体成分的另一重要组成部分。脂肪组织的区域分布已被证明比总体过度肥胖更能预测健康风险。因此,我们分析不同性别、年龄和BMI的健康人第三腰椎水平的脂肪组织分布和内脏肥胖的比例情况。在BMI正常的男性中,60岁前内脏肥胖的比例逐渐升高,≥60岁时略有下降。BMI正常的女性中,内脏肥胖的比例随着年龄的增长而逐渐增加, 在超重或肥胖的男性和女性中,内脏肥胖比例随年龄的增长呈进行性增加,不管在哪一个年龄层,内脏性肥胖的比例都是非常高的。可以看到,无论年龄如何,BMI正常、超重或肥胖,男性内脏肥胖的比例明显高于女性。这可能与老年人、男性患者有更高的代谢性疾病发生风险相关,内脏肥胖已成为比BMI更可靠的肥胖指标。因此,我们在管理肥胖人群的时候,不要只关注BMI,更要关注内脏性肥胖[10]。
衰弱是营养不良的另一种表现,是指生理储备能力下降和外界刺激易感性增加的临床综合征,表现为肌肉收缩功能受损,身体机能减退;一些急性重症患者短时间内疾病快速的变化,虽然肌肉含量还没有出现明显的变化,但是功能已经有显性的变化。因此,对患者进行功能评估至关重要。衰弱的常用评估方法有握力、6m步行速度、6min步行距离、5次坐起时间、简易体能状况量表和肝衰弱指数。
肝衰弱指数(liver frailty index,LFI)是2017年提出的一种新的肝病患者特异性衰弱指数,反映了门诊终末期肝病患者的身体衰弱表型,包含3个部分:握力、平衡试验、5次坐起试验。一项美国8个地区的1093名肝硬化患者中的前瞻性研究,将衰弱的变化分为四类:改善、稳定、缓慢进展、快速进展。研究发现,3个月内每降低0.1个单位的LFI,等待肝移植的死亡率风险增加3.91倍;衰弱状态恶化的患者,6个月死亡率为12.1%,而改善的患者,6个月的死亡率仅为0.6%[11]。
多项指南强调了个体化营养治疗在终末期肝病营养管理中的重要作用。


我团队刘兴博士在肝衰竭患者个体化营养干预方面进行了研究,纳入了2016年12月至2019年3月,就诊于北京佑安医院存在营养风险的52例肝衰竭患者。在综合内科治疗的基础上,根据患者静息能量消耗情况,对存在营养风险的肝衰竭患者进行为期2周的个体化的营养干预。在基线及营养干预后每周对患者的营养状态、病情程度及并发症进行评估并记录患者的热量及营养素摄入情况。根据患者的能量摄入是否达到REE的1.2倍将患者分为两组。
在基线时,两组患者无差异。在个体化营养干预1周及2周时,与能量摄入<1.2REE的患者相比,能量摄入≥1.2REE 的患者具有更高的RQ和更低的MELD评分[12],60例完成个体化营养干预的患者随访180天后分为存活组和死亡组,死亡组的平均能量摄入/静息能量消耗及平均呼吸商均低于存活组。平均能量摄入/REE是预测肝衰竭患者死亡的独立因素,最佳预测值是1.15。将患者能量摄入是否达到1.2REE将患者分为2组,<1.2REE与≥1.2REE患者180天存活率分别为45.2%和88%[13]。
肝脏在营养代谢中发挥重要的作用,终末期肝病患者存在营养物质、能量代谢异常,营养不良发病率高;能量代谢检测、人体成分、衰弱评估是诊断营养不良的重要方法;营养干预未来前景广阔,个体化营养治疗举足轻重。
本文转自:肝胆相照平台
本文仅供医疗卫生专业人士为了解资讯使用,不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解资讯以外的目的,平台及作者不承担相关责任。









评论
网友评论:
共评论。点击查看